Хлорацетон и Бромацетон
Хлорацетон и бромацетон — бесцветные жидкости, с резким запахом, нерастворимые в воде, растворимы в спирте и ацетоне. Температура кипения бромацетона — 126–127ºС, хлорацетона — 119ºС. Оба ОВ устойчивы к детонации и не разрушаются при взрыве. Так как хлор- и бромацетон склонны к разложению, при хранении к ним добавляют стабилизаторы — окись магния или пиперидин, при использовании окиси магния в качестве стабилизатора, эти ОВ могут сохранять раздражающие свойства до 20 лет. Основным недостатком хлорированных кетонов считается их быстрое разрушение при контакте с металлической оболочкой снаряда, что сильно усложняло промышленное производство боеприпасов. Первые гранаты с этими ОВ приходилось изготавливать из стекла, а позже им на смену пришли снаряды со свинцовым или эмалевым внутренним покрытием.
Хлорацетон
H3C-C(O)-CH2-Cl
Химические названия: Chloroacetone, 1-Chloro-2-propanone, Monochloroacetone, Monochloropropanone
Военные шифры: Франция: Tonite, Martonite (с бромацетоном и SnCl4). Германия: A-Stoff. США: G-22, G-154 (BC, Martonite), G-122, G-196 (со скипидаром)[17,18]
Впервые хлорацетон получил Riche в 1859 году при электролизе смеси соляной кислоты и ацетона. Хлорацетон обладал высокой летучестью, что позволяло создавать непереносимую концентрацию на открытой местности, в отличие от состоявшего на вооружении французской армии этилбромацетата, который был эффективен только в закрытых помещениях. Хлорацетон оказывает преимущественно слезоточивое действие, но при длительном воздействии может вызвать конъюнктивит, кератит и помутнение роговицы. При высоких концентрациях оказывает удушающее действие подобно фосгену. Британское военное министерство начало экспериментировать с хлорацетоном весной 1914 года, но признало его непригодным для военного применения[11]. А вот французские химики проявили к хлорацетону гораздо больший интерес. В январе 1915 года директор лаборатории органической химии в Сорбонне профессор Габриэль Бертран (Gabriel Bertrand) представил на рассмотрение военного ведомства проект необычной гранаты. Она имела форму шара и состояла из 6 чугунных фрагментов, окружавших круглую стеклянную колбу. При ударе об землю стекло разбивалось, освобождая пары хлорацетона[1].

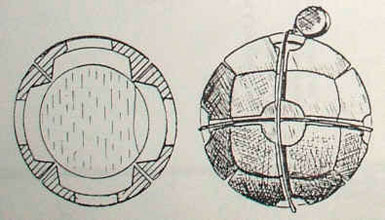
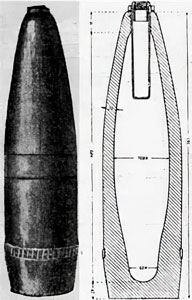
Слева и в центре — французская стеклянная газовая граната Bertrand No 1 образца 1915 года,
справа — русская газовая граната с хлорацетоном и хлорпикрином (1916).
В апреле 1915 года армия получила первую партию гранат Bertrand No.1, а с середины мая французская промышленность производила уже 3 тыс. гранат в сутки. Однако эффективность нового оружия была невелика, так как при весе 500 грамм граната вмещала всего 25 грамм лакриматора. В октябре 1915 года был налажен выпуск улучшенной модификации гранаты Bertrand No.1 с увеличенным до 100 грамм содержанием ОВ, а хлорацетон в ней решили заменить акролеином[1]. Начиная с 1915 года хлорацетон постепенно вытесняется более эффективным бромацетоном.
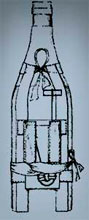
В конце 1915 года в России были начаты испытания ручной химической гранаты, содержащей смесь хлорацетона и хлорпикрина. Граната представляла собой обычную стеклянную бутылку объемом около 300 мл с примотанным к ней запалом. Однако, несмотря на простоту конструкции, такая граната «... обладала свойством путем сильного раздражения глаз ослеплять противника на то короткое время, которое является достаточным для внесения смятения и расстройства в рядах противника». К концу лета 1916 года этот тип гранат начал поступать на вооружение российской армии[14].
Накануне Второй мировой, во Франции гидрат тетрахлорацетона рассматривали не только как возможный лакриматор, но и как везикант. Синтезировавший его химик, так описывает действие тетрахлорацетона на человека: «от его паров веки сжимаются до такой степени, что невозможно открыть глаза даже на мгновение, одновременно ощущается головокружение. При нанесении на кожу это масло вызывает образование пузырей, которые впоследствии вызывают очень сильные боли. Его пары действует на кончики пальцев подобно плавиковой кислоте»[22].
В СССР военные химики проявляли интерес и к дихлорпроизводным ацетона — в 1926–1927 годах проф. С.С. Намёткин изучал возможность применения дихлорацетона в качестве БОВ, а известный советский военный токсиколог А.А. Лихачёв проводил его испытания на студентах-добровольцах[9].
Симметричный дихлорацетон ClCH2-C(O)-CH2Cl, помимо выраженного раздражающего действия на глаза и органы дыхания, даже в низких концентрациях оказывает «крапивное» действие на кожу[7]. Токсикологические исследования симм-дихлорацетона проводились в Эджвудском арсенале в 1931–1932 годах[15]. Также сильным слезоточивым действием обладает α,β-дихлорметилэтилкетон ClCH2-C(O)-CH2CH2Cl[16].
| Название | Формула | ICmin (inhalation, man)[5] |
LD50 (skin, rabbit) |
|---|---|---|---|
| Monochloroacetone | ClCH2-C(O)-CH3 | 18 мг/м3[21] | 141 mg/kg[21] |
| 1,3-Dichloroacetone | ClCH2-C(O)-CH2Cl | — | 53 mg/kg[19] |
| 1,1,3-Trichloroacetone | Cl2CH-C(O)-CH2Cl | 0,8 мг/м3 | — |
| 1,1,3,3-Tetrachloroacetone | Cl2CH-C(O)-CHCl2 | — | 80 mg/kg[19] |
| 1,1,1,3,3-Pentachloroacetone | Cl3C-C(O)-CHCl2 | 0,9–1,0 мг/м3 | — |
| Hexachloroacetone | Cl3C-C(O)-CCl3 | 0,9 –1,0 мг/м3 | 2980 mg/kg[20] |
| 1,3-Dichlorotetrafluoroacetone | F2ClC-C(O)-CClF2 | — | 91 mg/kg[20] |
| 1,1,3-Trichloro-1,3,3-trifluoroacetone | Cl2FC-C(O)-CF2Cl | — | 770 мг/кг[20] |
| Chloropentafluoroacetone hydrate | F3C-C(O)-CF2Cl· |
— | 81 mg/кg[20] |
| Hexafluoroacetone hydrate | F3C-C(O)-CF3·2H2O | 32 мг/м3 | 113 mg/кg[20] |
ICmin (мг/м3) — минмальная раздражающая концентрация для человека в мг/м3
LD50 (skin) — среднесмертельная концентрация при нанесении на кожу кролика в мг/кг
Добавление в молекулу фтора повышает кожно-резорбтивную токсичность, хлорпентафторацетона гидрат ClF2C-C(O)-CF3·2,5H2O обладает выраженным раздражающим действием и чрезвычайно токсичен при попадании на кожу — смертельная доза для кролика всего 81 мг/кг. Наиболее тяжелые поражения кожи наблюдались после нанесения трихлортрифтроацетона Cl2FC-C(O)-CF2Cl. Все хлорфторзамещенные производные ацетона оказывают угнетающее действие на ЦНС[20].
Бромацетон
H3C-C(O)-CH2-Br
Химические названия: Bromoacetone, 1-Bromo-2-propanone, Monobromoacetone
Военные шифры: Франция: Martonite, Blotite, Campiellite (с бромцианом и бензолом), Martonite (с хлорацетоном и SnCl4). Германия: B-Stoff, Be-Stoff, T-Grün-Geschoß, T-Grün Stoff, A-Stoff. США: CA, BA, G-13, MD5 shipping code, Y2 Dow Chemical Co.[17,18]
Бромацетон считается более сильным лакриматором, чем хлорацетон. Несмотря на то, что бромацетон даже в стеклянных или эмалированных оболочках быстро теряет активность, он устойчив к детонации и практически не разрушается при разрыве снаряда. Бромацетон относится к нестойким ОВ, через 24 часа после его применения на местности даже не сохраняется запаха[4].
Кроме сильного слезоточивого действия, при попадании на кожу аэрозоля или жидкого бромацетона возникают болезненные пузыри, которые через непродолжительное время проходят, не вызывая осложнений. Через евстахиевы трубы или поврежденную барабанную перепонку, пары бромацетона могут попасть в среднее ухо, вызывая воспаление и непереносимую боль.
В лабораторных условиях бромацетон получают при взаимодействии раствора брома в ацетоне с броматом натрия и серной кислотой при 30–35°C
10CH3-CO-CH3 + 4Br2 + 2NaBrO3 + 2H2SO4 = 10CH3-CO-CH2Br + 2NaHSO4 + 6H2O
Во Франции бромацетон получали несколько другим способом:
NaClO3 + 3NaBr + 3CH3-CO-CH3 + 3H2SO4 = 3CH2Br-CO-CH3 + 3NaHSO4 + NaCl + 3H2O
Такая методика позволяла более экономно расходовать дефицитный бром, но на выходе получался не чистый бромацетон, а смесь состоящая из 20% бромацетона и 80% хлорацетона. Эта рецептура получила название Martonit.
Смесь бром- и хлорацетона получила кодовое название Martonit и применялась французами начиная с 1915 года. Еще одна рецептура под названием Campiellite, состояла из бромциана, бромацетона и бензола. Всего за годы войны на заводах Франции для нужд армии было выпущено 481 тонн бромацетона[6]. Начиная с лета 1918 года французы стали заменять бромацетон на более эффективныйб бромбензилцианид.
Так же, как и французские, первые немецкие химические гранаты с бромацетоном представляли собой стеклянные шары диаметром 85 мм заполненные 250 мл ирританта. Для того чтобы их было удобно метать, они помещались в сетку, которая с помощью крючка крепились к поясному ремню. Такие стеклянные гранаты транспортировались и хранились в картонных ящиках с опилками. На смену стеклянной гранате пришли химические гранаты, изготовленные из листового металла (Kugelhandgranate).
Бромацетон немецкого производства имел свои особенности, он дополнительно содержал дибромпроизводные, которые усиливали его слезоточивое и удушающее действие.
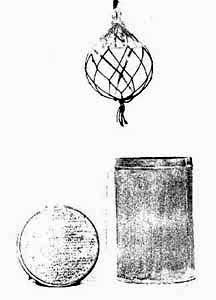 Немецкая стеклянная газовая граната |
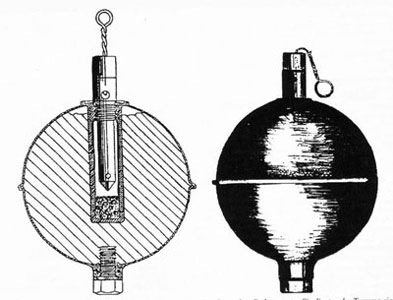 Немецкая ручная химическая граната |
Австро-венгерская армия использовала 80- и 150-мм снаряды содержавшие смесь бромциана и бромацетона. Однако такая комбинация ОВ со временем теряла токсические свойства и вскоре на вооружение стали поступать боеприпасы содержащие отдельно бромциан (Ce-Stoff) и отдельно бромацетон (Be-Stof). При артобстрелах их обычно комбинировали в пропорции 6:1 — на шесть снарядов с бромцианом приходился один с бромацетоном или бромэтилметилкетоном[10].
За годы войны только в артиллерийских снарядах было использовано более 1000 тонн бромацетона[3].
3-бромо-1,1,1-трифторпропанон BrCH2-C(O)-CF3 — кроме того, что является мощным лакриматором и легочным ирритантом, оказывает еще и выраженное кожно-нарывное действие, почти не уступает ему по активности 3,3-дибромо-1,1,1-трифторпропанон Br2CH-C(O)-CF3, а вот 1,1,1-трибром-3,3,3-трифторпропанон Br3C-C(O)-CF3 вызывает лишь небольшое слезотечение[8].
Йодацетон
H3C-C(O)-CH2-I
Химические названия: Iodoacetone, 1-Iodo-2-propanone
Военные шифры: Франция: Bretonite (с SbCl4), Litonite
Слезоточивое действие йодацетона, такое же как и у хлорацетона, но он значительно более ядовитый и по токсичности не уступает фосгену. Разрушается при хранении, нагревании и контакте с воздухом. Йодацетон использовался в специальных артиллерийских снарядах с футлярным снаряжением. Внутри такого снаряда располагался тонкостенный свинцовый футляр, устойчивый к агрессивному воздействию ирританта. Впервые применен французами в августе 1915 года. Выбор йодацетона в качестве боевого отравляющего вещества был вынужденной и временной мерой, вызванной дефицитом брома во Франции. К концу 1915 французская промышленность перешла на производство снарядов с более эффективным бензил йодидом.
 |
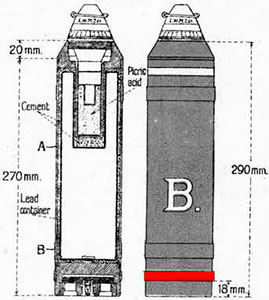 |
| Французский артиллерийский снаряд с йодацетоном | 76 мм немецкая мина с бромметилэтикетоном |
Бромметилэтилкетон
H3C-CH2-C(O)-CH2-Br
Химические названия: brommethylethyl ketone, 1-Bromo-2-butanone
Военные шифры: Франция: Homomartonite, Германия: Bn-Stoff [17]
Если французы испытывали проблемы с бромом, то немцам катастрофически не хватало ацетона, который был необходим в производстве взрывчатых веществ. Попытка заменить его метилэтлкетоном в производстве слезоточивых отравляющих веществ оказалось не слишком удачной, новый ирритант вызывал коррозию стенок снаряда, да и боевое его применение не оправдало надежд. По своему действию бромметилэтилкетон лишь немного уступает бромацетону и его эффект длится меньше. 150-мм снаряды, имевшие маркировку K1, начали поступать на вооружение немецкой армии осенью 1915 года. Каждый такой снаряд содержал 2,3 литра бромированного метилэтилкетона. Кроме того, бромэтилметилкетон и ксилил бромид заливались в 76 мм мины (B-Minen) и ручные гранаты (T-Granate). Также в Германии выпускался 150-мм гаубичный снаряд, снаряженный смесью бромметилэтилкетона и дифосгена[17].
Французские химики разработали свою рецептуру под названием Гомомартонит (Homomartonite), которая состояла из смеси бромметилэтилкетона и хлорметилэтилкетона.
В 1923–1926 годах бромметилэтилкетон, хлопикрин и иприт применяли испанские войска в Марокко, во время Рифской войны[12].
После Первой мировой войны, в 20–30-х годах прошлого века, немецкая компания CFS выпускала химические пистолеты и ампулы для газоокуривания с бромацетоном и бромметилэтилкетоном.
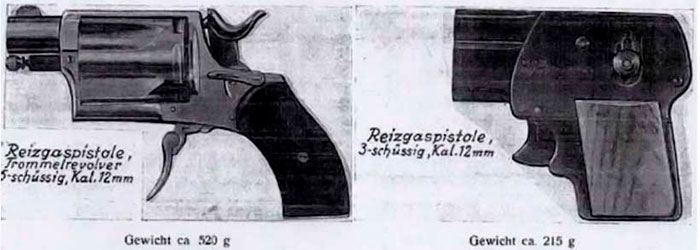
Согласно рекламной брошюре, пистолеты фирмы CFS предназначались для полиции, охранников, сельских почтальонов, банковских служащих и велосипедистов[13].
| Хлорацетон | Бромацетон | Йодацетон | Бромэтилметилкетон | |
| Формула | CH3COCH2Cl | CH3COCH2Br | CH3COCH2I | ClCH2COCH2CH3 |
| Минимальная раздражающая концентрация (мг/м3) | 18 | 1,5 | — | 12,6 |
| Непереносимая концентрация в течении 1 минуты (мг/м3) | 100 | 10 | 120 | 16 |
| Смертельная при 10-минутном воздействии (мг/м3) | 2300 | 3200 | — | 2000 |