Адреномиметики
Альфа-2-адреномиметики (α2-агонисты, α2-адреностимуляторы) — фармакологическая группа веществ вызывающая стимуляцию α2-рецепторов адренэргической системы. В медицине α2-адреномиметики применяются в качестве седативных средств, в отличие от α1-адреномиметиков, которые относятся к группе гипотензивных препаратов.
Воздействие альфа-адреномиметиков на организм человека[1]
Центральная нервная система
Вызывают глубокую седацию. Устраняют тревожность. Оказывают центральное обезболивающее действие. Вызывают гипотермию.
Сердечно-сосудистая система
Двухфазное действие на артериальное давление: после кратковременного повышения, длительное снижение. Уменьшение частоты сердечных сокращений (брадикардия). Ухудшают кровоток в сосудах сердца и мозга.
Дыхательная система
Угнетают дыхание только в дозах, значительно превышающих терапевтические. Клофелин может устранять спазм бронхов, вызванный другими веществами.
Пищеварительная система
Вызывают тошноту и сухость во рту. Блокируют секрецию воды и электролитов в просвет тонкой кишки и могут быть эффективны для лечения секреторной диареи (водянистом стуле).
Мочевыделительная система
Обладают мочегонным действием.
Эндокринная система
Повышают секрецию гормона роста. Уменьшают выработку инсулина, повышают уровень сахара крови.
Глаза
Расширение зрачка (мидриаз), снижение внутриглазного давления
Преимущества и недостатки. Внезапное и глубокое угнетение сознания, которое вызывают инкапаситанты из группы опиоидов, ингаляционных и диссоциативных анестетиков, может привести к травмам при падениях или судорогах, асфиксии вследствие западения языка или аспирации рвотных масс, синдрому позиционного сдавления.
Инкапаситанты из группы α2-адреномиметиков относятся ко второму поколению нелетального химического оружия (EA 5995, EA 5955, EA 5978)[11]. Действие α2-адреномиметиков отличается от других снотворных и наркотических средств — они не выключает полностью, а как бы «затуманивают» сознание[2] и даже в высоких дозах не вызывают анестезии[21]. Под воздействием адреномиметиков человек может оставаться в сознании, но полностью утрачивает способность к любым активным действиям.
Большинство α2-адреномиметиков всё же оказывают негативное влияние на сердечно-сосудистую систему, что затрудняет их использование в качестве самостоятельных инкапаситантов. Поэтому в последние десятилетия их применение в нелетальном оружии рассматриватеся только в сочетании с другими веществами угнетающими ЦНС — анестетиками, опиоидами и транквилизаторами.
«Нокаутирующие газы» времен холодной войны
В 1942 году американский фармаколог N. Fabricant предложил для лечения заложенности носа «новые, эффективные и безопасные» капли под названием Привин (Privine), основным действующим веществом которых был нафазолин — адреномиметик из группы производных имидазолина[27]. Лекарство оказалось настолько удачным, что до сих пор пользуется популярностью. В странах бывшего СССР оно известно под названием Нафтизин.
Вскоре, после начала массовых продаж Привина, стали появляться сообщения о побочном седативном действии новых капель у детей и некоторых особо чувствительных индивидуумов, но тогда этот необычный эффект не привлек внимания фармакологов.
Прошло 10 лет после открытия Привина. В 1952 году Центральное разведывательное управление США приступило к реализации масштабной программы по контролю над психикой человека под кодовым названием MK-ULTRA. Одним из самых приоритетных и потому наиболее щедро финансируемым проектом был поиск «нокаутирующих препаратов» или K-агентов» — химических веществ, вызывающих у человека кратковременную потерю сознания. Огромная армия химиков, фармакологов и врачей, работавших по контракту с ЦРУ над этой программой, тщательно отслеживали и сообщали обо всех веществах, которые могли бы привести человека в бессознательное состояние.
В 1953 году один из психиатров, сотрудничавших с ЦРУ, случайно обнаружил, что при назначении пациентам препаратов в состав которых входил Привин, у них развивалось состояние, напоминающее шок[56]. Этот необычный эффект вызвал большой интерес у исследователей из разведывательного управления, в одном из документов по программе MK-Ultra даже сохранилась нарисованная от руки формула будущего перспективного соединения, которое представляло гибрид привина и недавно открытого мощного нейролептика — хлорпромазина. Как сказано в документе, подобные вещества можно будет использовать при проведении специальных операций «против отдельных лиц или небольших групп»[57]. Чем закончились поиски «чудодейственного привина» навсегда останется тайной, так как в 1973 году почти все документы по программе MK-ULTRA были уничтожены.
 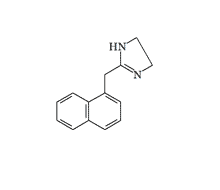
Naphazoline |
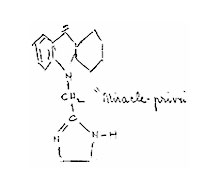
«Чудодейственный Привин» по версии ЦРУ |
 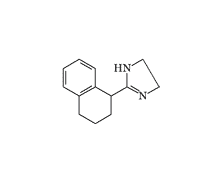
Tetrahydrozoline |
Действующее вещество глазных капель «Визин» (Visine) — тетрагидрозолин, имеет формулу похожую на привин, но без метиленового мостика. Кроме сосудосуживающего, он также оказывает выраженное гипнотическое действие — достаточно всего 2–3 мг препарата, чтобы через 20–30 минут погрузить человека в сон. Фирма «Pfizer» в 1959 году даже получила патент на использование «визина» в капсулах в качестве снотворного средства[36]. Однако, тяжелые побочные эффекты[37], иногда со смертельным исходом[38], заставили отказаться от этой идеи.
Клонидин (Clonidine), более известтный в странах бывшего СССР под торговым названием «Клофелин», был впервые синтезирован в 1962 году немецкой компанией Boehringer Ingelheim. Новый препарат оказывал сосудосуживающее действие и изначально его планировали использовать в каплях от насморка. Кроме того, в экспериментах на животных, он снижал артериальное давление и замедлял сердечный ритм. Как-то придя на работу, руководитель исследовательской группы доктор M. Wolf, заметил, что его секретарша простудилась и страдает от насморка, и предложил ей испытать на себе новое экспериментальное средство. После того как бедная женщина закапала несколько капель, она погрузилась в глубокий сон, длившийся сутки. Так, неожиданно, было открыто седативное действие клофелина. Как посчитали позже, она приняла дозу равную 20 таблеткам клофелина[28,29].

Clonidine (Catapres, Клофелин )
В середине 80-х годов в больницы стали массово поступать пациенты в бессознательном состоянии с низким артериальным давлением и редким пульсом. У тех, кто приходил в себя, любые попытки сесть, а тем более встать на ноги заканчивались обморочным состоянием. Некоторые жаловались на потерю памяти, слуховые и зрительные галлюцинации, искажение цветового восприятия — окружающие предметы казались окрашенными в красно-черные тона[5]. Все они были жертвами криминального отравления клофелином и, как правило, были ограблены после распития спиртных напитков с незнакомыми людьми (случайными попутчиками, проститутками, такистами).
К середине 90-х годов массовые случаи отравления клофелином приняли характер эпидемии — по данным Е. А. Лужникова (1995) острые отравления клофелином составляли до 30% больных с лекарственными интоксикациями[42]. Но еще гораздо большее количество потерпевших с отравлением легкой или средней тяжести не обращались за медицинской помощью, да и причиной многих «внезапных» и «скоропостижных» смертей вне больничных учреждений также часто был клофелин.
Данные о токсичности клофелина противоречивы, несмотря на высокий терапевтический индекс у животных, достигающий нескольких тысяч[33], прием всего 4 мг клофелина (20 таблеток) в сочетании с алкоголем может вызывать остановку дыхания у человека[34]. В дозе свыше 0,01 мг/кг клофелин вызывает гипотонию и брадикардию, угнетение дыхание и апноэ могут наступить начиная с дозы 0,02 мг/кг[32]. Но все же случаи смертельного отравления достаточно редки, по данным Американской ассоциации центров по лечению отравлений (ААРСС), из 6 000 случаев передозировки у детей и подростков только один закончился смертью 2-летнего ребенка[31].
О возможном применении клонидина в качестве химического оружия стали сразу же писать вскоре после его открытия[40], а его химическая структура на последующие десятилетия определила направление развития инкапаситантов из группы адреномиметиков. Но изначально считалось, что утрату боеспособности клонидин способен вызывать только за счет сильного гипотензивного действия, такого как у каннабиноидов.
В 1957 году исследователи из компании Pfizer сообщили об испытаниях на животных 2-(1-нафтиламино)-2-оксазолина — представителя нового и очень перспективного класса депрессантов ЦНС и пообещали в ближайшее время опубликовать подробности о его фармакологических свойствах[35]. Но так и не опубликовали, вероятнее всего, потому что решили найти препаратам этой группы военное применение.
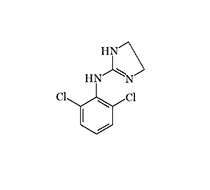
В 1964 году фармацевтическая компания Pfizer заключила с Эджвудским центром химических исследований, разработок и технологии ERDEC контракт на поиск и испытание препаратов способных вызвать у человека временную утрату боеспособности – инкапаситантов. Биологическая активность одного из первых синтезированных соединений под шифром 400,386 оказалась «соизмеримой с требованиями, предъявляемыми к современным инкапаситантам»[19]. По химическому строению вещество 400,386 — это все тот же нафазолин, в котором метиленовый мостик заменили на аминогруппу. В результате дальнейшей работы был обнаружен еще более сильнодействующий препарат 400,483, который в дозе 1–3 мкг/кг вызывал у подопытных животных атаксию, снижение двигательной активности, понижение артериального давления и брадикардию. При этом терапевтический индекс (LD50/ED50) этих веществ достигал несколько тысяч[19].
 |
 |
 |
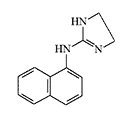 |
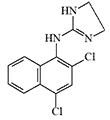 |
 |
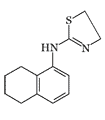
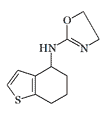
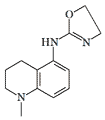
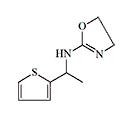
В это же время в другой американской компании DuPont проводились испытания главного конкурента вещества 400,386 – тетрагидронафтилоксазолина (119,902). В дальнейшем внимание разработчиков переключилось на производные аминооксазолина и аминотиазолина. Вещества этой группы, при ингаляционном воздействии в виде аэрозоля, вызвали кратковременное обездвиживание лабораторных животных продолжительностью от получаса до нескольких часов, при этом эффективная доза была в 300–750 раз меньше смертельной[20].
При всей привлекательности, новые инкапаситанты DuPont все же уступали по активности другим известным инкапаситантам того времени. Для иммобилизации животных требовались относительно высокие концентрации вещества — не менее 100–500 мг∙мин/м3, что в несколько раз выше, чем у LSD-25 и вещества BZ[20/10]. Начало действия также было относительно медленным — животные впадали в прострацию только через 3–5 минут после начала экспозиции. Для усиления угнетающего действия на ЦНС и уменьшения брадикардии, производные оксазолина и тиазолина испытывали на животных в сочетании с холинэргическими веществами[21], в частности, вещества 119,902 с EA 3443 и BZ[58].
Разработка «усыпляющих газов» в 80–90-е годы
После открытия в 1977 году Berthelsen and Pettinger α1- и α2- подклассов адренорецепторов, у химиков и фармакологов наконец появилась возможность селективного скрининга седативных α2-адреномиметиков лишенных побочного гипотензивного действия.
Медетомидин (Medetomidine, Domitor®) — селективный агонист α2-адренорецепторов, был разработан финской фармацевтической компанией Orion Corporation в 1987 году и вначале применялся только в ветеринарной практике. В 1999 году правовращающий изомер медетомидина под торговой маркой (Precedex®) был разрешен для применения в медицине в качестве седативного средства. Препарат обладает очень высокой активностью – введение человеку всего 0,12 мг дексмедетомидина вызывает в 75% случаев сон.
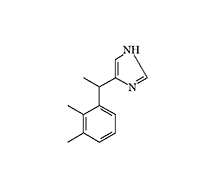
Medetomidine (Precedex)
В отличие от опиоидных анальгетиков, медетомидин не угнетает дыхания, но часто даже в терапевтических дозировках вызывает гипотензию и брадикардию.
Медетомидин удовлетворяет большинству требований предъявляемым к химическим инкапаситантам: он является фармакологическим препаратом, и поэтому его действие на человека хорошо изучено, он активен в очень низких дозах, имеет достаточно высокий индекс безопасности и у него есть специфический антидот.
Благодаря высокой липофильности, медетомидин оказывает быстрое действие на ЦНС, а его растворы могут всасываться с поверхности кожи. Кроме аэрозольной формы, рассматривается применение медетомидина в смеси с диметилсульфоксидом (DMSO) в нелетальном оружии струйного или пейнтбольного типа[11,55]. Диметилсульфоксид повышает проницаемость кожи для адреномиметиков, как показал один из экспериментов, скорость всасывания нафазолина при добавлении к нему диметилсульфоксида возрастала в 25 раз[41]. При попадании в глаза, на слизистые оболочки или кожу, медетомимдин может вызывать раздражение.
В конце 80-х — начале 90-х годов в Эджвудском центре химических исследований, разработок и технологии (ERDEC) продолжается поиск инкапаситантов из группы селективных α2-адреномиметиков. С помощью компьютерного моделирования пытаются найти связь между химическим строением и седативным действием влияния адреномиметиков[7]. Также ERDEC получает от европейских фармацевтических компаний образцы новых препаратов этой группы, отбирая для испытаний вещества с наиболее высокой биологической активностью. Как, например, соединение A-62033 синтезированное фирмой Abbot[25,26], но которое оказалось непригодным в качестве инкапаситанта из-за своей экстремально высокой токсичности — в дозе всего 0,0035 мг/кг A-62033 вызывал смертельно опасное снижение артериального давления у животных[21].
Еще один препарат UK-14304 — оказывал угнетающее действие на ЦНС начиная с дозы 0,001 мг/кг и по седативному действиию превосходил медетомидин и нафтилмедетомидин[21]. Этот препарат сейчас известен, как средство для лечения глаукомы под торговой маркой «Alphagan» (Brimonidine), но близкие по строению производные хиноксалина и хинолина были синтезированы и протестированы при участии ERDEC в начале 90-х годов[48].
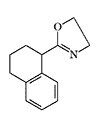
119,902 |
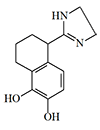
A-62033 |
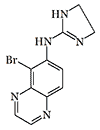
Brimonidine |

Medetomidine |
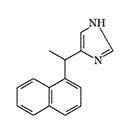
Naphthylmedetomidine |
Также ERDEC интересовали замещенные в метиленовом мостике[50,59] и 2-имидазолиновые аналоги медетомидина[49]. Основное внимание было направлено на изучение бициклических и трициклических аналогов медетомидина[51,60-62]. Наиболее активные из полученных соединений в дальнейшем планировалось разделять на оптические изомеры и выделить более активные (S)-стереоизомеры[61]. Данные об активности синтезированных адреномиметиков в экспериментах на животных не публиковались.
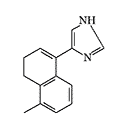 |
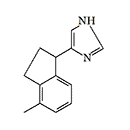 |
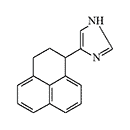 |
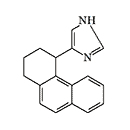 |
Конформационно-ограниченные аналоги медетомидина, синтезированные при участии ERDEC в начале 90-х годов
В 1994 году в Эджвудском научно-исследовательском центре (ERDEC) был утвержден трехлетний план по исследованию воздействия адреномиметиков на человека. Согласно этому документу, несмертельные средства на их основе планировалось применять для противодействия массовым беспорядкам, защиты дипломатических представительств и борьбы с терроризмом. Полиция и ФБР также были заинтересованы в надежных и безопасных средствах для использования в таких ситуациях, как захват заложников, задержание опасных подозреваемых, подавление тюремных бунтов и других подобных сценариях. На исследования в этой области предполагалось потратить в 1995–1996 годах около 1,3 млн долларов[5].
Для несмертельных технологий представляют интерес комбинации дексмедетомидина с анальгетиками, анестетиками и седативными средствами, при этом доза последних может быть уменьшена до 5% без потери эффективности[1]. В медицине наибольшее распространение получила комбинация медетомидина с кетамином, при этом кетамина необходимо минимальное количество. Кроме того, медетомидин уменьшает неблагоприятное действие кетамина на центральную и сердечно-сосудистую системы. В 2001 году Управление войск химической и биологической защиты США (USASBCCOM) проводило испытания на животных трехкомпонентного состава — кетамин / мидазолам / медетомидин, как потенциального инкапаситанта для военных и правоохранительных целей[43]. С этим же составом экспериментировали начиная с 2002 год в чешской Военно-медицинской академии[39], в его испытаниях участвовали добровольцы из числа медицинских сестёр. После внутримышечной инъекции этого состава, иммобилизация наступала через 2–4 минуты[55].
Работы по изучению инкапаситантов группы медетомидина активно ведутся в иранском Университете имени имама Хусейна. В 2011 году там был разработан аэрозольный состав для временного выведения из строя на основе 5,5% раствора медетомидина в этиловом спирте[46]. В 2013 году там же изучался трехкомпонентный состав, в который помимо медетомидина входили анестетики кетамин и севофлуран[47]. В 2014–2015 годах иранские химики предложили улучшенные методики синтеза медетомидина и нафтилмедетомидина[52,53].
В России, вероятно, существует интерес к инкапаситантам этой группы. Так, например, химиками связанными с Государственным НИИ органической химии и технологии (ГосНИИОХТ), разработан способ получения медетомидина, по эффективности превосходящий все известные раннее[30].
Нафтилмедетомидин
Нафтилмедетомидин (YA-II-085). В 1989 году на ежегодной конференции по Химической защите, проводимой в Эджвудском арсенале, группа химиков из ERDEC и университета Огайо сообщила о синтезе нового адреномиметика, сопоставимого по активности с медетомидином — нафтилмедетомидина[45]. Через два года, на такой же конференции, были представлены результаты экспериментов на животных, которые подтвердили его более выраженное, чем у медетомидина седативное действие, в сочетании с меньшим влиянием на артериальное давление[21]. В 1992 году был выдан патент на использование нафтилмедетомидин в качестве седативного и гипотензивного лекарственного средства[24]. Еще больший интерес может представлять (+)(S)-изомер нафтилмедетомидина, намного более активный агонист α2-рецепторов, чем (-)(R)-изомер[3,12]
Действие комбинации нафтилмедетомидин /кетамин / гиалуронидаза на приматов
 |
 |
 |
слева – «типичное» положение макака-резуса через 5 минут после инъекции (Votava, 2009), в центре — сохраненный хватательный рефлекс на фоне глубокой седации у шимпанзе (Hess, 2010), справа — иммобилизация орангутана (Hess, 2010)
Чешские исследователи нелетального оружия изучали нафтилмедетомидин начиная с 2008 года в экспериментах на мышах (2008)[17], кроликах (2009)[15], макаках-резусах (2009)[18], шимпанзе и орангутанах (2010)[44]. В отличие от медетомидина, нафтилмедетомидин не вызывал потери сознания или иммобилизации, а лишь умеренную седацию. Побочное действие на сердечно-сосудистую и дыхательную систему у него было менее выраженным. Но его главным отличием было полное подавление агрессии, подопытные животные не реагировали на прикосновения и манипуляции и при этом оставались в состоянии бодрствования. Эффект нафтилмедетомидина наступал быстро, агрессивность исчезала в течение 2 минут после внутримышечной инъекции[18]. Также чешские ученые изучали воздействие на приматов комбинации из нафтилмедетомидина, кетамина и мидазолама, в которую для ускорения действия добавляли фермент гиалуронидазу[44].
Лечение отравлений
Антидотная терапия. При отравлении клофелином у людей применяют специфический антидот Толазолин (Tolazoline): 10 мг внутривенно или 50 мг внутрь нейтрализуют эффект 0,6 мг клофелина.
Симптоматическая терапия включает в себя инфузионную терапию, форсированный диурез, введение вазоактивных препаратов. В тяжелых случаях прибегают к экстракорпоральным методам детоксикации, таким как операция замещения крови и гемосорбция (30–100% ОЦК)[6]. Атропин устраняет гипотонию и брадикардию вызванные клофелином, но для лечения отравлений применяется редко. Применение налоксона также не рекомендуется[9].
При передозировке медетомидина у животных применяют антидот Атипамезол (Atipamezole, Antisedan® ) в дозе в 3–6 раз превышающую дозу введенного медетомидина. Действие адреномиметика исчезает в течение 5–10 мин. .
Для нелетальных технологий может представлять интерес сочетание α2-адреномиметика с периферическим антагонистом α2-адренорецепторов, таким как, например, Ватиноксан (Vatinoxan), который устраняет нежелательные побочные эффекты на сердечно-сосудистую систему, но сохраняет седативное действие адреномиметиков. Атипамезол не блокирует полностью действие нафтилмедетомидина, даже после его введения животные оставались безразличными и не проявляли агрессивности[44]
Xylazine |
Romifidine |
Jing Song Ling |
Detomidine |
M. J. Hoyer (2006) описал, как случайно ввел себе 3 мг Ромифидина (Romifidine, Sedivet®). Вскоре он почувствовал сильную сонливость, нарушилась координация движений и он с трудом мог разговаривать. Появились галлюцинации, речь стала бессвязной и он потерял сознание. Когда его доставили в больницу, артериальное давление упало до 70/50 мм.рт.столба, а частота пульса снизилась до 30 ударов в минуту. После симптоматического лечения состояние улучшилось[8].
| Формула | Эффективная концентрация IC (мг·)мин/м3 |
Дозировка (ID) мг/кг |
LD50 мг/кг |
Терапевтический индекс |
|---|---|---|---|---|
 |
1200–2000 +2400–4000 скополамина (обезьяны)[20/13] |
— | 56 (мыши, в/венно) |
— |
 |
1200–2000 +2400–4000 скополамина (обезьяны)[20/13] |
— | — | — |
 |
3000 (песчанки)[20/8] |
2 (крысы в/брюшинно) |
— | более 30 |
 |
3000 (песчанки)[20/10] |
— | — | более 30 |
 |
2500 (обезьяны)[20/9,10] |
— | 42 (мыши, в/венно) |
более 50 |
 |
5000 (мыши)[20/11] |
0,02 (мыши, в/венно) |
4,2 (мыши, в/венно) |
250 |
 |
2000 (мыши)[20/11] |
0,01 (мыши, в/венно) |
— | 1300 |
 |
— | 0,032 (мыши,в/венно) |
20 (мыши, в/венно) |
625[19] |
| — | 0,0056 (крысы, в/венно) |
22,4 (крысы, в/венно) |
400[19] | |
| — | 0,01 (собаки, в/венно) |
1,5 (собаки, в/венно) |
150[19] | |
 |
— | 0,01 (мыши, в/венно) |
22,4 (мыши, в/венно) |
2240[19] |
| — | 0,0018 (крысы, в/венно) |
3,16 (крысы, в/венно) |
1755[19] | |
| — | 0,001 (собаки, в/венно) |
1,5 (собаки, в/венно) |
1500[19] | |
 |
— | 0,01 (мыши, в/венно) |
31,6 (мыши, в/венно) |
3160[19] |
| — | 0,018 (крысы, в/венно) |
56,2 (крысы, в/венно) |
3120[19] | |
| — | 0,1 (собаки, в/венно) |
>5 (собаки, в/венно) |
50[19] |